엔탈피 측정을 통한 헤스의 법칙 확인
엔탈피 측정을 통한 헤스의 법칙 확인

엔탈피 측정을 통한 헤스의 법칙 확인

엔탈피 측정을 통한 헤스의 법칙 확인
목차
1. 목적
2. 키워드
3. 실험이론
4. 시약 및 기구
5. 실험 방법
6. 결과 분석
7. 참고문헌
목적
NaOH와 HCl의 반응을 단계적으로 진행시켜 각 단계의 엔탈피를 측정하고 헤스의 법칙이 성립하는지 확인한다.
키워드
헤스의 법칙
엔탈피
상태함수
중화반응
열용량
상태함수 (State functions)
계의 상태를 나타내는 함수
ex) 압력, 부피, 온도, 엔탈피
경로에 무관하게 상태에만 의존
경로함수와 반대개념
실험 원리
엔탈피 (H, Enthalpy)
어떤 물질이 갖고 있는 고유한 총에너지 함량
상대적인 엔탈피 변화만 측정할 수 있음
실험 원리
H = Hf - Hi
H [ 0 발열반응
H ] 0 흡열반응
헤스의 법칙 (Hess’s law)
화학반응에서 반응열은 그 반응의 시작과 끝 상태만으로 결정되며, 도중의 경로에는 관계하지 않는다.
반응열을 직접 측정하는 것이 곤란한 경우, 다른 화학반응식의 조합에 의해 그 반응열을 산출할 수 있다.
실험 원리
H = H1 + H2
헤스의 법칙 (Hess’s law)
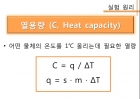
열용량 (C, Heat capacity)
어떤 물체의 온도를 1℃ 올리는데 필요한 열량
실험 원리
C = q / T
q = s · m · T
열량계 (calorimeter)
....
목차
1. 목적
2. 키워드
3. 실험이론
4. 시약 및 기구
5. 실험 방법
6. 결과 분석
7. 참고문헌
목적
NaOH와 HCl의 반응을 단계적으로 진행시켜 각 단계의 엔탈피를 측정하고 헤스의 법칙이 성립하는지 확인한다.
키워드
헤스의 법칙
엔탈피
상태함수
중화반응
열용량
상태함수 (State functions)
계의 상태를 나타내는 함수
ex) 압력, 부피, 온도, 엔탈피
경로에 무관하게 상태에만 의존
경로함수와 반대개념
실험 원리
엔탈피 (H, Enthalpy)
어떤 물질이 갖고 있는 고유한 총에너지 함량
상대적인 엔탈피 변화만 측정할 수 있음
실험 원리
H = Hf - Hi
H [ 0 발열반응
H ] 0 흡열반응
헤스의 법칙 (Hess’s law)
화학반응에서 반응열은 그 반응의 시작과 끝 상태만으로 결정되며, 도중의 경로에는 관계하지 않는다.
반응열을 직접 측정하는 것이 곤란한 경우, 다른 화학반응식의 조합에 의해 그 반응열을 산출할 수 있다.
실험 원리
H = H1 + H2
헤스의 법칙 (Hess’s law)
열용량 (C, Heat capacity)
어떤 물체의 온도를 1℃ 올리는데 필요한 열량
실험 원리
C = q / T
q = s · m · T
열량계 (calorimeter)
....

-
 일반화학실험 - 헤스의 법칙
일반화학실험 - 헤스의 법칙
결과 보고서 헤스의 법칙 1. Abstract 엔탈피가 상태함수이기 때문에 출발물질과 최종 물질이 같은 경우에는 어떤 경로를 통해서 만들더라도 그 경로에 관여된 엔탈피 변화의 합은 같다는 것을 헤스의 법칙 이.. -
 일반화학실험 - 헤스의 법칙
일반화학실험 - 헤스의 법칙
1. 요약 1. 실험의 목적 : 수산화나트륨과 염산의 반응을 통해 헤스의 법칙이 상태 함수임을 확인한다. 2. 실험 방법 . 첫 번째 엔탈피의 측정 a. 250ml 비커를 씻어서 말린 후에 무게를 측정하고 스티로폼 .. -
 화학실험 - 헤스의 법칙
화학실험 - 헤스의 법칙
헤스의 법칙 1. 1. Abstract and Introduction 1) 실험목적 대부분의 화학 반응이 진행되는 동안에는 열의 흡수 또는 방출이 수반된다. 화학 반응시에 방출되는 열량은 각 물질의 엔탈피를 계산하여 예측할 .. -
 일반화학실험 - 헤스의 법칙
일반화학실험 - 헤스의 법칙
1. Abstract and Introduction 1.1 실험 목적 이번 실험은 산과 염기의 중화 반응을 이용하여 엔탈피(H, Enthalpy)가 상태 함수임을 알아보고, 헤스의 법칙이 실제로 성립함을 확인해 보고자 하는 실험이다. 먼.. -
 화학실험결과 - 헤스의 법칙(총열량 불변의 법칙)
화학실험결과 - 헤스의 법칙(총열량 불변의 법칙)
화학실험결과 - 헤스의 법칙(총열량 불변의 법칙) Ⅰ. Introduction 화학에서 열은 아주 기본적이다. 화학의 관심은 원자의 재배열을 통한 물질의 변화에 있고 물질의 변화에는 열의 출입이 수반되기 때문이다. .. -
 일반화학실험 - 엔탈피 측정
일반화학실험 - 엔탈피 측정
1. 목적 산과 염기의 중화 반응을 이용하여 엔탈피가 상태함수임을 확인한다. (핵심개념: 엔탈피, 상태함수, 헤스의 법칙, 반응열, 생성열) 2. 이론 1) 열역학 제1 법칙에 의한 에너지 U와 엔탈피 H에 대한 정.. -
 엔탈피 측정
엔탈피 측정
실험 . 엔탈피 측정 실험목적 산과 염기의 중화 반응을 이용해서 엔탈피가 상태함수임을 확인한다. ※ 과제 : 엔탈피, 상태함수, 헤스의 법칙, 반응열, 생성열, 비열용량 이론 대부분의 경우에 화학 반응이.. -
 화학반응 - 화학반응열의 측정과 Hess의 법칙
화학반응 - 화학반응열의 측정과 Hess의 법칙
화학반응열의 측정과 Hess의 법칙 1. Abstract (요약) 대부분의 화학반응이 진행되는 동안에는 열의 흡수 또는 방출이 수반된다. 화학 반응시에 방출되는 열량을 각 물질의 엔탈피를 계산하여 예측할 수 있다. .. -
 일반화학실험 - 헤스의 법칙
일반화학실험 - 헤스의 법칙
헤스의 법칙 1. Introduction 엔탈피는 아주 중요하다. 밤새 호흡이 중단되어 열의 발생이 몇 시간 멈춘다면 아침에 우리는 싸늘한 시체가 되어 있을 것이다. 차에 휘발유를 넣고 달리는 경우를 생각해 보자. 탄.. -
 [일반화학실험] 반응열 측정
[일반화학실험] 반응열 측정
[일반화학실험] 반응열 측정 Ⅰ. 실험주제 반응열 측정 Ⅱ. 실험목적 화학 반응에서의 엔탈피 개념에 대해 이해하고 헤스의 법칙을 실제 실험에 적용시켜 본다. Ⅲ. 실험원리 1. 계와 주위 화학 반응이 일어날 ..