반응차수 측정
반응차수 측정

반응차수 측정

화학반응속도 측정(반응차수측정)
목 차
목적
원리
기구 및 시약
실험 방법
주의 사항
참고 문헌
실 험 목 적
반응물의 초기농도를 변화시켜 초기반응속도를 측정함으로써 반응차수를 구할 수 있다. 본 실험에서는 KI(아이오딘화칼륨) 촉매하에 과산화 수소를 분해하는 반응에서 산소 발생속도로부터 반응속도를 구하여 H2O2 (과산화수소) 및 KI에 대한 반응차수를 결정하는 방법을 알아본다.
실험 이론
반응속도
- 반응물이나 생성물의 단위시간당 농도 변화
- 화학 반응이 빠르게 또는 느리게 일어나는 정도
- 단위 시간 동안에 감소한 반응 물질의 몰농도나
증가한 생성 물질의 몰농도(mol/L초, mol/L분)
반응속도에 영향을 주는 요인
반응 물질의 성질, 농도,
표면적, 온도, 촉매
농도와 반응속도
반응물질의 입자들이 충돌해야 화학반응이 일어남.
농도증가→단위부피 분자들의 입자 수 증가→분자들의 충돌횟수 증가→반응속도 증가
농도에 따른 반응속도의 변화의 실생활 예시
액체 산소 속에서 다이아몬드가 연소한다.
강철솜은 공기 중에서는 연소되지 않으나, 산소가 든 집기병 속에서는 격렬하게 연소한다.
대장간에서는 풀무질로 공기를 불어넣어 불길을 세게 한다.
표면적과 반응속도
반응 물질이 고체인 경우
표면적 증가 → 반응 물질 간의 접촉 면적 증 가 → 반응 물질 간의 충돌 횟수가 증가 → 반응 속도증가.
표면적에 따른 반응 속도의 변화 예
석탄 가루가 많은 탄광의 갱내에서나 밀가루 공장에서는 폭발 사고가 자주 일어난다.
알약보다는 가루약이 흡수가 훨씬 빠르다.
통나무보다는 잔가지가 불이 훨씬 잘 붙는다.
암석의 기계적 풍화가 진행되어 틈새가 벌어지면 암석의 화학적 풍화 속도도 빨라진다.
소장의 내벽은 작고 부드러운 융털로 덮여 있어 영양소가 빠르게 흡수된다.
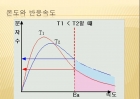
온도와 반응속도
온도에 따른 반응 속도 변화의 예
....
목 차
목적
원리
기구 및 시약
실험 방법
주의 사항
참고 문헌
실 험 목 적
반응물의 초기농도를 변화시켜 초기반응속도를 측정함으로써 반응차수를 구할 수 있다. 본 실험에서는 KI(아이오딘화칼륨) 촉매하에 과산화 수소를 분해하는 반응에서 산소 발생속도로부터 반응속도를 구하여 H2O2 (과산화수소) 및 KI에 대한 반응차수를 결정하는 방법을 알아본다.
실험 이론
반응속도
- 반응물이나 생성물의 단위시간당 농도 변화
- 화학 반응이 빠르게 또는 느리게 일어나는 정도
- 단위 시간 동안에 감소한 반응 물질의 몰농도나
증가한 생성 물질의 몰농도(mol/L초, mol/L분)
반응속도에 영향을 주는 요인
반응 물질의 성질, 농도,
표면적, 온도, 촉매
농도와 반응속도
반응물질의 입자들이 충돌해야 화학반응이 일어남.
농도증가→단위부피 분자들의 입자 수 증가→분자들의 충돌횟수 증가→반응속도 증가
농도에 따른 반응속도의 변화의 실생활 예시
액체 산소 속에서 다이아몬드가 연소한다.
강철솜은 공기 중에서는 연소되지 않으나, 산소가 든 집기병 속에서는 격렬하게 연소한다.
대장간에서는 풀무질로 공기를 불어넣어 불길을 세게 한다.
표면적과 반응속도
반응 물질이 고체인 경우
표면적 증가 → 반응 물질 간의 접촉 면적 증 가 → 반응 물질 간의 충돌 횟수가 증가 → 반응 속도증가.
표면적에 따른 반응 속도의 변화 예
석탄 가루가 많은 탄광의 갱내에서나 밀가루 공장에서는 폭발 사고가 자주 일어난다.
알약보다는 가루약이 흡수가 훨씬 빠르다.
통나무보다는 잔가지가 불이 훨씬 잘 붙는다.
암석의 기계적 풍화가 진행되어 틈새가 벌어지면 암석의 화학적 풍화 속도도 빨라진다.
소장의 내벽은 작고 부드러운 융털로 덮여 있어 영양소가 빠르게 흡수된다.
온도와 반응속도
온도에 따른 반응 속도 변화의 예
....

-
 [일반화학실험] 시계 반응
[일반화학실험] 시계 반응
[일반화학실험] 시계 반응 (1)Abstract -속도 결정 단계가 포함된 메카니즘으로 일어나는 화학 반응 중에서 반응이 시작되고 일정한 시간이 지난 후에 갑자기 용액의 색깔이 변하는 반응을 시계 반응(Clock reacti.. -
 [화학실험보고서] 화학반응속도-시계반응
[화학실험보고서] 화학반응속도-시계반응
[화학실험보고서] 화학반응속도-시계반응 실험목적 농도 변화에 따른 반응속도를 측정함으로써 반응속도상수와 반응차수를 결정 할 수 있다. 실험원리 반응속도 - 화학반응이 빠르게 또는 느리게 일어나는 정도 .. -
 화학실험 - 화학반응 속도와 농도
화학실험 - 화학반응 속도와 농도
화학반응 속도와 농도 차 례 1.실험 목적 2.실험 원리 3.실험 기구 및 시약 4.실험 방법 5.실험 결과 실험 목적 를 염산용액으로 환원시키는 화학반응의 속도를 측정함으로써 농도가 반응속도에 주는 영향을 알.. -
 [일반화학실험] 화학반응속도-시계반응
[일반화학실험] 화학반응속도-시계반응
[일반화학실험] 화학반응속도-시계반응 -목 차- 1. 실험목적 2. 실험도구 1) 기구 1) 시약 3. 이론 1) 시계반응 2) 반응속도에 대한 농도의 영향 3) 반응속도식 / 반응속도상수 / 반응차수 4) 녹말 지시.. -
 화학실험 - 화학 반응 속도 (시계반응)
화학실험 - 화학 반응 속도 (시계반응)
실험 제목; 화학 반응 속도 (시계반응) 1. 실험 목적 반응 물질의 농도를 달리하여 시계반응으로 속도를 측정하고, 반응속도 상수와 반응차수를 구한다. 2. 실험 이론 계산기 반드시 지참하세요 이론으로 조사.. -
 화학 반응 속도 - 시계반응
화학 반응 속도 - 시계반응
실험 제목; 화학 반응 속도 (시계반응) 1. 실험 목적 반응 물질의 농도를 달리하여 시계반응으로 속도를 측정하고, 반응속도 상수와 반응차수를 구한다. 2. 실험 이론 ① 반응 속도 물체의 운동을 나타낼 때 .. -
 화학반응 속도 - 시계반응에 관하여
화학반응 속도 - 시계반응에 관하여
실험 제목; 화학 반응 속도 (시계반응) 1. 실험 목적 반응 물질의 농도를 달리하여 시계반응으로 속도를 측정하고, 반응속도 상수와 반응차수를 구한다. 2. 실험 이론 ① 반응 속도 물체의 운동을 나타낼 때 .. -
 [실험보고서] 화학 반응 속도 [시계반응]
[실험보고서] 화학 반응 속도 [시계반응]
실험 제목; 화학 반응 속도 (시계반응) 1. 실험 목적 반응 물질의 농도를 달리하여 시계반응으로 속도를 측정하고, 반응속도 상수와 반응차수를 구한다. 2. 실험 이론 ① 반응 속도 물체의 운동을 나타낼 때 .. -
 예비 - 설탕의 전화
예비 - 설탕의 전화
설탕의 전화 -실험 예비 보고서- 1. 목적 효소 및 수소이온을 촉매로 하여 설탕(sucrose)이 가수분해되는 전화속도를 편광계로 추적하여 그 동력학적 해석을 한다. 2. 이론 화학반응의 반응속도는 온도, 농도 등.. -
 일반화학실험 - 화학반응속도 구하기
일반화학실험 - 화학반응속도 구하기
1. 실험 주제 : 화학반응속도 구하기 2. 실험 목적 화학 반응 속도 식을 나타내는 데에 필요한 속도 상수와 반응 차수를 실험적으로 결정한다. 3. 실험 이론 및 원리 화학반응에 영향을 미치는 요인에는 농도..